1. Introduction
On estime que 20 % de tous les médicaments pharmaceutiques à petites molécules sont halogénés.1 Les liaisons carbone-halogène conduisent à un large éventail d’effets, notamment une augmentation de la stabilité thermique et oxydative et une amélioration de la perméabilité des membranes biologiques [1]. En outre, dans la découverte de médicaments, les produits naturels (PN) représentent des supports biologiquement précieux et leur halogénation peuvent encore améliorer leurs propriétés. Une étude antérieure a démontré le potentiel de l’halogénation chimique sur les plantes pour obtenir des composés bioactifs [2]. Dans ce contexte, une stratégie pour l’halogénation générique des extraits de plantes a été développée pour constituer des bibliothèques de NP halogénés originaux, en particulier pour la recherche de nouveaux agents antifongiques. Pour commencer, la réaction d’halogénation a été réalisée avec une série d’étalons de NP de différentes classes chimiques. Une fois la réaction terminée avec succès, différents extraits de plantes ont été soumis à la même procédure générique d’halogénation (Br, I) [3].
2. Halogénation oxydative des produits naturels
Dans ce travail, l’idée était d’utiliser une réaction d’halogénation écologique [3] qui utilise des halogénures de sodium dans une solution aqueuse de peroxyde d’hydrogène et de l’appliquer à une série de NP purs et d’extraits bruts pour estimer si cela pouvait augmenter leurs activités antifongiques.
Procédure Halogénation
- Chloration : 6 eq NaCl – 1g standard – 6eq H2O2 – 10mL CH3COOH – jusqu’à 25mL avec H2O
- Bromation : 6 eq NaBr – 1g standard – 6eq H2O2 – 10mL CH3COOH – jusqu’à 25mL avec H2O
- Iodation : 3 eq NaI – 1g standard – 6eq H2O2 – jusqu’à 25mL avec H2O
- Temps de réaction : 24h
- Température ambiante
- Sous agitation magnétique
- Chimie Verte
Réaction chimique
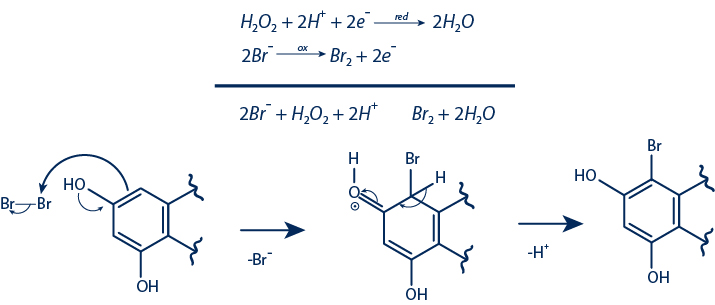
Composés semi-synthétiques obtenus par halogénation oxydative
Rendement de 0.7% à 29%
Une série d’étalons de NP avec différents squelettes ont été sélectionnés pour l’halogénation. Les réactions ont été effectuées avec 50 mg de chaque composé. Les purifications des dérivés halogénés ont été réalisées par HPLC-UV semi-préparatifs en phase inverse.
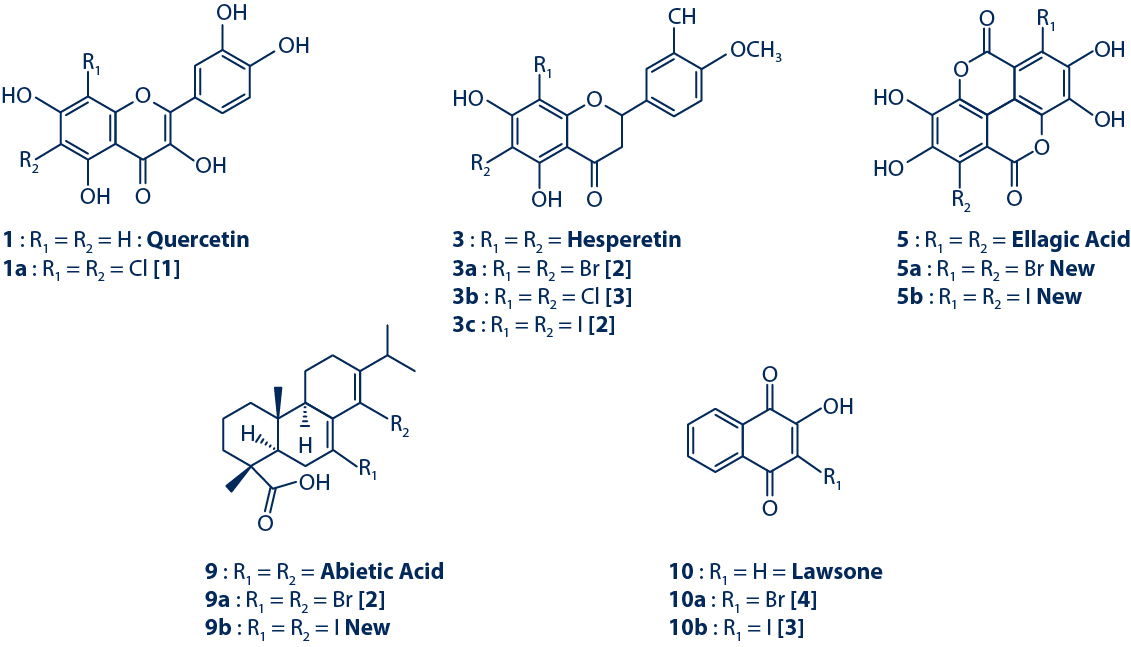
3. Essai antifongique contre C. albicans
L’activité antifongique des dérivés halogénés purifiés a été évaluée contre C. albicans en utilisant à la fois le test de bioautographie (MIQa) et le test de dilution (MIC).
C. albicans
Souches : CAF21
DSY 2621
Essai de bioautographie antifongique

4. Sélection d’un extrait brut riche en flavonoïdes
Espèces d’agrumes 8,5% de la production mondiale de fruits
 40 à 60 % des oranges sont utilisées pour les jus de fruits 50% de péricarpe sur le poids total |
Une fois la réaction d’halogénation validée avec la série de standards, la méthodologie a été appliquée à un extrait végétal brut modèle (péricarpe de Citrus sinensis) riche en flavonoïdes et facile à obtenir à grande échelle. |
Consitutants du Péricarpe de Citrus sinensis
| Composants | wt% sur la base du poids sec |  |
| Cendre (%) | 2.56 | |
| Sucre (%) | 9.57 | |
| Matière grasse (%) | 4.00 | |
| Protéine (%) | 9.06 | |
| Flavonoid (%) | 4.50 | |
| Pectine (%) | 23.02 | |
| Lignine (%) | 7.52 | |
| Cellulose (%) | 37.08 | |
| Hemicellulose (%) | 11.04 |
5. Bromation de l’extrait méthanolique de péricarpe d’agrumes
L’halogénation de l’extrait méthanolique a été la première effectuée à l’échelle analytique avec 100 mg de l’extrait pendant 24h. Après cela, la réaction a été arrêtée et contrôlée par HPLC-UV (A). Le mélange réactionnel brut a présenté une forte activité antifongique contre C. albicans. Afin d’isoler ces composés actifs, la réaction a été portée à 1 g en conservant le même temps de réaction (24 h) (B). Le mélange réactionnel a été séché et purifié par chromatographie flash (FC) en phase normale. Les conditions préparatives ont d’abord été déterminées à l’échelle analytique et ensuite transposées à l’échelle préparative en utilisant la même phase stationnaire [5]. Les fractions obtenues sont séchées et soumises à l’essai antifongique permettant la localisation des quatre composés actifs (1-4). L’élucidation structurale de ces composés a été réalisée par HRMS et NMR.
a. Analyse HPLC UV de l’extrait brut après et avant la réaction

b. Chromatographie Flash Ultra Pression en Phase Normale

6. Conclusion
L’halogénation d’une série de standards NP a été trouvée efficace pour générer des composés antifongiques contre l’agent pathogène fongique humain Candida albicans. La réaction a été menée avec une condition écologique utilisant des réactifs doux. La méthodologie a également été appliquée avec succès à l’halogénation d’un extrait complexe de plante brute obtenu à partir d’un déchet (péricarpe d’agrumes) générant des dérivés halogénés antifongiques. Ces résultats préliminaires démontrent une fois de plus l’importance du potentiel d’halogénation chimique des extraits de plantes pour obtenir des produits naturels bioactifs “non naturels” d’intérêt. Dans ce contexte, l’application de ces réactions aux extraits bruts de la biomasse des déchets peut avoir un grand intérêt à produire des produits bioactifs de valeur NPs.
La prochaine étape sera l’évaluation des dérivés halogénés contre différentes cibles biologiques et l’application de cette méthodologie à un grand nombre d’extraits de plantes à compositions chimiodiverses.
7. Références
1. Herrera-Rodriguez et al. Chem Today 2011;29:4
2. Mendez et al. ACS Comb Sci. 2011;13:200-204
3. Bernini et al. New J Chemi. 2015;39:2980-2987
4. Favre-Godal et al. Phytochemistry 2014;105:68-78
5. Challal et al. Planta Med. 2015; 81: 1636-1643
En savoir plus :
 |
|